Свойства ортофосфорной кислоты: Ортофосфорная кислота. Свойства и применение ортофосфорной кислоты
- Ортофосфорная кислота — использование в качестве антиоксиданта, удобрения и для удаления ржавчины
- Фосфорная кислота — формула, характеристика и свойства химического вещества
- Характеристика ортофосфорной кислоты: физические и химические свойства, получение и история открытия
- Ортофосфорная кислота — это… Что такое Ортофосфорная кислота?
- Е338 — это… Что такое Е338?
- Кислота ортофосфорная
- Фосфорная кислота — использование и свойства фосфорной кислоты и ее применение
- Структура, химическая формула и свойства фосфорной кислоты
- Фосфорная кислота | 7664-38-2
- Фосфорная кислота Химические свойства, использование, производство
- Описание
- Химические свойства
- Физические свойства
- Происшествие
- История
- использует
- использует
- использует
- использует
- Определение
- Препарат
- Методы производства
- Методы производства
- фирменное наименование
- Общее описание
- Реакции воздуха и воды
- Профиль реактивности
- Опасность для здоровья
- Пожарная опасность
- Использование в сельском хозяйстве
- Применение в фармацевтике
- Промышленное использование
- Профиль безопасности
- Безопасность
- Химический синтез
- Возможное облучение
- Канцерогенность
- хранилище
- Доставка
- Несовместимость
- Удаление отходов
- Нормативный статус
- Продукты и сырье для получения фосфорной кислоты
- Сырье
- Препараты
- Фосфорная кислота Химические свойства, использование, производство
- Фосфорная кислота
- Фосфорная кислота — Sciencemadness Wiki
- фосфорная кислота | Купить качественную фосфорную кислоту
- Фосфорная кислота 85% (общее использование)
- Ищете другие варианты этого продукта?
- Описание
- Ищете фосфорную кислоту для общего применения?
- Химические и физические свойства фосфорной кислоты
- Обычное применение фосфорной кислоты
- Насколько безопасна фосфорная кислота?
- Вежливое обслуживание
- Файлы MSDS
- Где я могу купить фосфорную кислоту в Великобритании?
- Что такое фосфорная кислота?
- Для чего используется фосфорная кислота?
Ортофосфорная кислота — использование в качестве антиоксиданта, удобрения и для удаления ржавчины
Любители газированного напитка «Кока-кола» вряд ли смотрят на его состав, имеющий добавку Е338. Этим веществом является ортофосфорная кислота, которая находит применение не только в пищевой промышленности, но и в текстильной, сельскохозяйственной и даже справляется с ржавчиной на поверхности деталей. Что за свойства у химического соединения, какие сферы его использования, что нужно знать о технике безопасности – стоит рассмотреть подробнее.
Что такое ортофосфорная кислота
При комнатной температуре это гигроскопичные бесцветные кристаллы ромбообразного вида, которые хорошо растворяются водой. Ортофосфорное соединение считается неорганической кислотой со средней силой. Одна из ее форм – желтоватая или бесцветная сиропообразная жидкость, без запаха, является водным раствором с концентрацией 85%. Другое ее название – белая фосфорная кислота.
Другое ее название – белая фосфорная кислота.
Химическое ортофосфорное соединение имеет свойства:
- растворяется в этаноле, воде, растворителях;
- образует 3 ряда солей – фосфатов;
- вызывает ожоги при попадании на кожу;
- при взаимодействии с металлами образует горючий, взрывоопасный водород;
- температура кипения зависит от концентрации – от 103 до 380 градусов;
- жидкая форма склонна к переохлаждению;
- несовместимо с горючими материалами, чистыми металлами, негашеной известью, алкоголем, карбидом кальция, хлоратами;
- при температуре 42,35 градуса плавится, но не разлагается.
Формула
Кислота ортофосфорная – неорганическое соединение, которое описывается формулой h4PO4. Его молярная масса равна 98 г/моль. Микрочастица вещества построена в пространстве так, что соединяет между собой атомы водорода и кислорода. Формула показывает – химическое вещество обладает таким составом:
Формула показывает – химическое вещество обладает таким составом:
|
Количество атомов
|
Процент массы
| |
|
Водород
|
3
|
3,1
|
|
Фосфор
|
1
|
65,3
|
|
Кислород
|
4
|
31,6
|
Получение фосфорной кислоты
Химическое соединение имеет несколько способов производства. Известный промышленный метод изготовления кислоты ортофосфорной – термический, при котором получается чистый продукт высокого качества. Происходит такой процесс:
Известный промышленный метод изготовления кислоты ортофосфорной – термический, при котором получается чистый продукт высокого качества. Происходит такой процесс:
- окисление во время сжигания при избытке воздуха фосфора до фосфорного ангидрида, имеющего формулу Р4О10;
- гидратация, абсорбция полученного вещества;
- конденсация фосфорной кислоты;
- улавливание тумана из газовой фракции.
Есть еще две методики производства ортофосфорного соединения:
- Экстракционный способ, отличающийся экономичностью. Его основа – разложение природных минералов-фосфатов соляной кислотой.
- При лабораторных условиях вещество получается взаимодействием белого фосфора, являющегося ядовитым с разбавленной азотной кислоты. Процесс требует строгого соблюдения техники безопасности.
Химические свойства
Неорганическое соединение считается трехосновным, имеющим среднюю силу. Характерны такие химические свойства ортофосфорной кислоты:
Характерны такие химические свойства ортофосфорной кислоты:
- реагирует на индикаторы изменением цвета на красный;
- при нагревании преобразуется в пирофосфорную кислоту;
- в водных растворах подвергается трехступенчатой диссоциации;
- при реакции с сильными кислотами образует фосфорилы – комплексные соли;
- образует желтый осадок, взаимодействуя с нитратом серебра;
- термически разлагается до дифосфорной кислоты;
- при контакте с основаниями, аморфными гидроксидами, образует воду и соль.
Применение
Кислота ортофосфорная применяется во многих областях, начиная от промышленности до лечения зубов. Средство используется умельцами как флюс при пайке, для очистки поверхности металла от ржавчины. Жидкость применяется:
- для научных исследований в молекулярной биологии;
- как катализатор процессов органического синтеза;
- для создания антикоррозионных покрытий металлов;
- при производстве огнеупорных пропиток для дерева.

Вещество находит применение:
- в нефтяной промышленности;
- при изготовлении спичек;
- для производства кинопленки;
- с целью защиты от коррозии;
- для осветления сахарозы;
- при изготовлении лекарств;
- в холодильных установках как связующее вещество в составе фреона;
- при механической обработке для полировки, очистки металлов;
- в текстильной отрасли при производстве тканей, имеющих огнезащитную пропитку;
- как компонент при получении химических реактивов;
- в ветеринарии для лечения мочекаменной болезни у норок;
- как составляющая для грунтовки по металлу.
В пищевой промышленности
Широкое распространение получило применение фосфорной кислоты при изготовлении продуктов питания. Она зарегистрирована в реестре пищевых добавок под кодом Е338. При употреблении с допустимыми количествами вещество считается безопасным. Полезными являются такие свойства препарата:
При употреблении с допустимыми количествами вещество считается безопасным. Полезными являются такие свойства препарата:
- предотвращение прогоркания;
- регулирование кислотности;
- продление срока годности;
- сохранение вкусовых характеристик;
- усиление действия антиоксидантов.
Кислота ортофосфорная как подкислитель, разрыхлитель, антиоксидант находит применение в хлебопечении, мясной, молочной промышленности. Используется при производстве кондитерских изделий, сахара. Вещество придает продуктам кисловатый, горьковатый вкус. Добавка Е338 входит в состав:
- плавленых сыров;
- сдобы;
- газированных напитков – «Пепси-кола», «Спрайт»;
- колбас;
- булок;
- молока;
- детского питания;
- мармелада;
- тортов.
Исследования показали, что злоупотребление продуктами, содержащими ортофосфорные соединения, особенно газированными напитками, может привести к появлению проблем со здоровьем. Не исключено:
Не исключено:
- вымывание из организма кальция, что может спровоцировать образование остеопороза;
- нарушение кислотно-щелочного баланса – добавка способна увеличивать его кислотность;
- появление заболеваний ЖКТ;
- обострение гастрита;
- разрушение эмали зубов;
- развитие кариеса;
- появление рвоты.
В непищевой промышленности
Применение ортофосфорной кислоты можно наблюдать во многих сферах производства. Часто это связано с химическими свойствами продукта. Препарат применяется для изготовления:
- комбинированных, фосфорных минеральных удобрений;
- активированного угля;
- фосфорных солей натрия, аммония, марганца;
- огнезащитных красок;
- стекла, керамики;
- синтетических моющих средств;
- огнеупорных связующих компонентов;
- негорючего фосфатного пенопласта;
- гидрожидкостей для авиационной промышленности.

В медицине
Стоматологи применяют ортофосфорный состав для обработки внутренней поверхности коронки. Это помогает во время протезирования улучшить ее сцепление с зубом. Вещество используется фармацевтами для приготовления лекарств, зубного цемента. В медицине применение ортофосфорного соединения связано со способностью протравливать эмаль зуба. Это необходимо при случае использования для пломбирования адгезивных материалов второго, третьего поколения. Важные моменты – после травления поверхность необходимо:
- промыть;
- просушить.
Применение от ржавчины
Преобразователь ржавчины на основе ортофосфорной кислоты создает на поверхности защитный слой, оберегающий от коррозии при дальнейшем использовании. Особенность применения соединения – безопасность для металла при нанесении. Существует несколько способов выполнить удаление ржавчины ортофосфорной кислотой, зависящих от размера повреждения:
- травление с погружением в ванну, иную емкость;
- многократное нанесение на металл состава пульверизатором, валиком;
- покрытие поверхности предварительно обработанной механической очисткой.

Ортофосфорное соединение производит преобразование ржавчины в фосфаты железа. Состав можно использовать для промывки и очистки:
- изделий металлопроката;
- скважин;
- поверхностей трубопроводов;
- парогенераторов;
- систем водоснабжения, отопления;
- змеевиков;
- бойлеров;
- водонагревателей;
- теплообменников;
- котлов;
- деталей машин и механизмов.
Взаимодействие ортофосфорной кислоты
Свойства неорганического вещества определяют его взаимодействие с другими веществами и соединениями. При этом происходят химические реакции. Ортофосфорный состав входит во взаимодействие с:
- солями слабых кислот;
- гидроксидами, вступая в реакцию нейтрализации;
- металлами, находящимися слева от водорода в ряду активности с образованием соли и выделением водорода;
- основными оксидами, участвуя в реакции обмена;
- гидроксидом аммония, создавая гидрофосфат аммония;
- аммиаком с получением кислых солей.

Техника безопасности при работе с кислотой
Ортофосфорное соединение относится к классу опасных веществ, требует соблюдения осторожности. Работы с составом должны проводиться в специальном помещении, оснащенном приточно-вытяжной вентиляцией, вдали от источников огня. Недопустимо отсутствие средств индивидуальной защиты:
- респиратора;
- перчаток;
- специальной одежды;
- нескользящих ботинок;
- очков.
Опасно попадание ортофосфорного состава на кожу, в глаза, вредно вдыхание горячих паров. Это может вызвать ожог, головокружение, рвоту, кашель. При экстренных случаях нужно:
- снять одежду, на которую попало вещество;
- промыть место поражения проточной водой;
- вызвать врача;
- наложить свободную повязку;
- разлитую жидкость нейтрализовать щелочью.

Правила транспортировки
Существуют специальные ГОСТы, оговаривающие правила перевозки кислоты ортофосфорной, которая относится к опасным грузам. Вещество может доставляться любым видом транспорта. Химически активная жидкость перевозится в плотно закрытых:
- стальных автоцистернах;
- бутылях из полиэтилена, стекла;
- пластиковых кубах;
- бочках;
- канистрах;
- гуммированных железнодорожных цистернах.
Цена
Кислоту ортофосфорную можно приобрести в аптеках, хозяйственных магазинах, заказать через интернет-сайты. Для промышленных целей приобретают оптом со скидками. Средняя стоимость для Москвы в рублях составляет:
|
Количество, литр
|
Средняя цена, р.
| |
|
Пищевая термическая
|
1
|
400
|
|
Техническая 85%
|
0,8
|
380
|
|
1600
|
13500
| |
|
Флюс для пайки
|
0,01
|
180
|
|
0,003
|
40
| |
|
Пищевая добавка Е388
|
1
|
85
|
Видео
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Рассказать друзьям:
Фосфорная кислота — формула, характеристика и свойства химического вещества
Физические свойства
Фосфорная (ортофосфорная) кислота с молярной массой 97,99 г/моль и эмпирической формулой h4PO4 — неорганическая трёхосновная кислота средней силы. Структурная формула молекулы в газообразном агрегатном состоянии описывается в виде тетраэдра, содержит в центре атом фосфора, а в вершинах — атом кислорода и три гидроксильные группы.
Состав следующий:
|
Наименование |
Количество атомов |
Массовая доля, % |
|
Водород (H) |
3 |
3,10 |
|
Фосфор (P) |
1 |
65,30 |
|
Кислород (O) |
4 |
31,60 |
При нормальных условиях бесцветные кристаллы гигроскопичны, плавятся на воздухе уже при 42,35 °C, легко растворяются в воде, этиловом спирте и других растворителях. Практическое применение имеют водные растворы трёх видов:
Практическое применение имеют водные растворы трёх видов:
|
Концентрация, % |
Температура плавления, °C |
Плотность, грамм/мл |
|
75 |
-20 |
1,579 |
|
80 |
0 |
1,633 |
|
85 |
+20 |
1,689 |
Сиропообразная жидкость без цвета и запаха 85%-й концентрации h4PO4 обычно и называется ортофосфорной кислотой, а кипячением в вакууме при 80 °C из неё выделяется безводная составляющая. В твёрдой фазе и в высококонцентрированных растворах молекулы фосфорной кислоты образуют межмолекулярные водородные связи.
При разбавлении на первое место выдвигаются водородные связи между фосфат-анионами PO43- и молекулами воды h3O.
Химические свойства
Растворы h4PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
- h4PO4 = H+ + h3PO4-.
- h3PO4— = H+ + HPO42-.
- HPO42- = H+ + PO43-.
Соответственно, и соли бывают как средними — фосфаты, так и кислыми — гидрофосфаты и дигидрофосфаты.
При комнатной температуре h4PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный. Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2h4PO4 = Al3 (PO4)2 + 3h3. Вступает в реакции нейтрализации с гидроксидами: 3NaOH + h4PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2h4PO4 = Mg3 (PO4)2 + 3h3O.
Вступает в реакции нейтрализации с гидроксидами: 3NaOH + h4PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2h4PO4 = Mg3 (PO4)2 + 3h3O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики. Повышение температуры приводит к дегидратации молекулы с образованием пирофосфорной и метафосфорной кислоты:
- 2h4PO4 = h3O + h5P2O7;
- h5P2O7 = h3O + 2HPO3.
Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: h4PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.
Основные способы получения
Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2h3O = 3h4PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4h4PO3 = 3h4PO4 + Ph4.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6h3O = 4h4PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода.
 Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация. - TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.

- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
- Дигидратные (CaSO4·2h3O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств.
 Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации. - Гемигидратные (CaSO4·0,5h3O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Осаждение безводной соли (ангидритный метод) теоретически осуществимо, но в промышленности не используется, так как вызывает серьёзные коррозионные проблемы.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода h3SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода h3SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Сферы использования продукта
Многие отрасли народного хозяйства по достоинству оценили свойства фосфорной кислоты. Применение её удивительно разносторонне — от научных исследований в молекулярной биологии до обеспечения хладагентами морозильных установок.
Производство минеральных удобрений потребляет львиную долю экстракционной кислоты, и ежегодно сюда расходуется более 90% фосфорсодержащих руд. Растениям фосфор необходим для образования семян и плодов, его добавки увеличивают резистентность к заморозкам и пересушиванию, что особенно существенно для северных областей с коротким периодом вегетации и слабым развитием почвенных микроорганизмов.
Пищевая промышленность заинтересовалась антиоксидантными и стабилизирующими свойствами фосфорной кислоты и успешно применяет их в составе добавки E338. Это предотвращает прогоркание, регулирует кислотность и продлевает сроки годности, придаёт вкус сиропам, газировке, мармеладу, хлебу и другой выпечке. Споры о вреде и пользе таких компонентов ведутся много лет, но альтернативы никто ещё не предложил, и пока что всё сводится только к разумному потреблению.
Металлообработка широко применяет фосфорную кислоту как флюс при пайке меди, чёрных металлов и нержавеющей стали. Очень эффективна также и очистка поверхностей от ржавчины — образуется защитная плёнка, предотвращающая дальнейшую коррозию.
Органический синтез использует h4PO4 как катализатор, авиационная промышленность включила в состав гидрожидкостей, деревообработка пропитывает древесину, делая её негорючей. В этом послужном списке достойно соседствуют звероводство, осветление сахарозы и изготовление лекарств, производство огнеупорных пропиток и стоматология, где фосфорная кислота применяется для протравливания зубных тканей перед пломбированием.
А ещё — получение активированного угля, огнеупорного стекла и керамики, огнезащитных лакокрасочных материалов, огнестойкого фосфатного пенопласта и древесно-стружечных плит. Соли фосфаты используются для умягчения жёсткой водопроводной воды и входят в состав СМС и средств, удаляющих накипи.
Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной h4PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.
Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Контакт имеет раздражающее действие при концентрации растворов до 10%, а свыше 25% — коррозионное и ожоговое.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Характеристика ортофосфорной кислоты: физические и химические свойства, получение и история открытия
Ортофосфорная кислота – наиболее известная без приставки «орто», как фосфорная кислота, представляет собой неорганическое соединение, обладающее комплексом физико-химических свойств характерных для кислот. Кислота имеет условное обозначение (химическую формулу) h4PO4 или h4O4P. В России под понятием фосфорная (ортофосфорная кислота) чаще имеется ввиду водный раствор 85%. С такими характеристиками жидкость представляет собой густой бесцветный раствор без запаха. Данная кислота является стабильным соединением в ряду кислот фосфора с содержанием кислорода.
Кислота имеет условное обозначение (химическую формулу) h4PO4 или h4O4P. В России под понятием фосфорная (ортофосфорная кислота) чаще имеется ввиду водный раствор 85%. С такими характеристиками жидкость представляет собой густой бесцветный раствор без запаха. Данная кислота является стабильным соединением в ряду кислот фосфора с содержанием кислорода.
В мировой практике может иметь альтернативные названия:
- Фосфорная кислота
- Ортофосфорная кислота
- О-фософорная кислота
- 7664-38-2
- Полифосфорная кислота
- Orthophosphoric acid
- Гидроген фосфат
- h4PO4
- h4O4P
В базе данных химических соединений и смесей Национального центра биотехнологической информации США (NCBI) PubChem имеет запись 1004, уникальный номер в реестре Chemical Abstracts Service 7664-38-2, уникальный номер в рамках Европейского сообщества 231-633-2.
В Российской Федерации фосфорную кислоту производят 8 заводов:
- АО «Воскресенские минеральные удобрения»
- АО «НИУИФ»
- ООО «Компонент-Реактив»
- АО «Апатит»
- ООО «НПФ Невский химик»
- ООО «Уфахимпроект»
- Славия
- ЕвроХим-БМУ
Не редким товаром на рынке химических кислот является ортофосфорная кислота из Республики Беларусь, Казахстана и Китая.
Смотрите, также: «Производство и продажа ортофосфорной кислоты: основные рынки»
Свойства ортофосфорной кислоты
Физические свойства
Если говорить о виде ортофосфорной кислоты то стоит знать, что чаще всего на рынке она представлена в растворах различных процентов содержания фосфора. Однако чистая фосфорная кислота представляет собой белый полупрозрачный кристаллический порошок, обладающий высокой степенью поглощения воды из воздуха, в связи, с чем характеризуется способностью видоизменяться на открытом воздухе. В растворах представлена в сиропообразной форме в следующих сочетаниях:
- 85% раствор ортофосфорной кислоты
- 80% раствор ортофосфорной кислоты
- 75% раствор ортофосфорной кислоты
Температура, при которой плавится чистая ортофосфорная кислота, составляет 42,35 °С. Фосфорная кислота растворима в воде, спирте и этанолах.
Основные показатели и физические свойства:
| Физическое состояние чистого вещества: | твердое |
| Наиболее часто встречающееся физическое состояние: | вязкое |
| Молярная масса: | 98,0 г/моль |
| Плотность раствора: | 1,75/см(куб) |
| Плотность вещества: | 1. 9 г/см(куб) 9 г/см(куб) |
| Растворимость: | полная, 48 г/100 мл |
| Температура кипения | 158 °С |
| Динамическая вязкость | 2,4-9,4 сПуаз |
Химические свойства
Ортофосфорная кислота – вещество средней силы. В водных растворах ведет себя в различных вариациях. Может, как выделять, так и поглощать тепло. Образовывать фосфаты, кислые соли. При нагревании из водного раствора получают пирофосфорную и метафосфорную кислоты.
Отличительной особенностью ортофосфорной кислоты от других содержащих фосфор, является желтый осадок как реакция на нитрат серебра.
Характеристики процессов с участием ортофосфорной кислоты:
- При смешивании с нитратом серебра выпадает осадок желтого цвета.
- В воде происходит распад в три этапа.
- Выделение пирофосфатов при сильном нагреве.
- Взаимодействие с химическим индикатором меняет цвет на красный.
- Производная сильного уровня в сочетании с ортофосфорной кислотой дает многогранные соли.

Публикация по теме: Сферы применения фосфорной (ортофосфорной) кислоты
История открытия
Открытие фосфорной кислоты произошло в XVII веке сразу в нескольких независимых лабораториях.
Первые упоминания об открытии фосфора относятся к немецкому ученому Хенингу Брандту. Разорившийся предприниматель, увлекшись алхимическими опытами в поисках «философского камня», подверг тщательном у изучению продукты человеческой жизнедеятельности. Выпарив мочу, и нагрев оставшийся осадок, Брандт получил белое вещество. Дальнейшие опыты с этим веществом заключающиеся в нагревании без доступа кислорода, помогли выделить легкоплавкое вещество с неприятным запахами и парами, светящимися в темноте. Первое название этого вещества имело очень мистический характер. «Холодный огонь», — именно так назвал свое открытие Хенинг Бранд.
В лаборатории англо-ирландского химика Роберта Бойля известного в научных кругах тем, что предпочитал опыт, а не домыслы в 1680 году фосфор был выделен при помощи опытов с индикаторами. Бойль (с подсказки Крафта) проведя ряд экспериментов с жидкостями, кровью, мочой, волосами и костями, поставил производство фосфора на коммерческую основу.
Бойль (с подсказки Крафта) проведя ряд экспериментов с жидкостями, кровью, мочой, волосами и костями, поставил производство фосфора на коммерческую основу.
Производство фосфора в XVII веке имело очень успешный коммерческий характер, из-за связи с алхимическими поисками, но в XVIII веке в связи с обнаружением еще одного способа получения (ученым Маргграфам Андреасам Зигизмундом) и его всесторонним раскрытием, перестало иметь коммерческую привлекательность.
Получение ортофосфорной кислоты
В XVII веке производство фосфорной кислоты происходило опытным путем. Через выпаривание и сжигание. Современный способ был найден около 100 лет назад, заключался в окислении фосфора азотной кислотой. Сейчас производство ортофосфорной кислоты происходит двумя способами: термическим и экстракционным.
Термический способ заключался в реакции фосфора на сжигание и воду. Сжигаемый при 2000 °C фосфор, переходит в оксид фосфора, поглощаемый фосфорной кислотой. Такая фосфорная кислота не содержит примесей фосфора в низших степенях окисления, но требует очистки от мышьяка.
Такая фосфорная кислота не содержит примесей фосфора в низших степенях окисления, но требует очистки от мышьяка.
Экстракционный способ в странах СНГ заключается в обработки хибинский апатитов и фосфоритов Кракатау природными фосфатами. Кроме ортофосфорной кислоты выделяется также дигидрат или гемигират сульфата кальция.
ООО «Эверест» осуществляет оптовые поставки фосфорной (ортофосфорной) кислоты по низким ценам. Подробнее по телефону: +7 (812) 448-47-55.
Рейтинг: 5/5 — 2 голосов
Похожие публикации
Ортофосфорная кислота — это… Что такое Ортофосфорная кислота?
| Ортофосфорная кислота | |
| Общие | |
|---|---|
| Систематическое наименование | Ортофосфорная кислота |
| Химическая формула | H3PO4 |
| Физические свойства | |
Состояние (ст. усл.) усл.) | твердое |
| Отн. молек. масса | 98,0 а. е. м. |
| Молярная масса | 98,0 г/моль г/моль |
| Плотность | 1,685 (жидк) г/см³ |
| Динамическая вязкость (ст. усл.) | 2,4-9,4 сПуаз Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 42,35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 2,12, 7,21, 12,67 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7664-38-2] |
Ортофо́сфорная кислота́ (фо́сфорная кислота́)[1] — неорганическая кислота средней силы, с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Получение
Фосфорную кислоту получают из фосфата:
Можно получить гидролизом пентахлорида фосфора:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
- (дигидрофосфат натрия)
- (гидрофосфат натрия)
- (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
См. также
Примечания
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter.- Vol.24,№ 11.-2000.-P.1-2.
Ссылки
Фосфорная кислота
Е338 — это… Что такое Е338?
Ортофо́сфорная кислота́ (H3PO4) — твёрдое вещество при комнатной температуре, бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют её 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других обычных растворителях.
Получение
Фосфорную кислоту получают из фосфорита:
- Са3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Можно получить гидролизом пентахлорида фосфора:
- PCl5 + 4 H2O → H3PO4 + 5 HCl
Или взаимодействием с водой оксида Р2O5, полученного сжиганием фосфора:
- Р2O5 + 3H2O = 2H3PO4
С водой реакция идет очень бурно, поэтому Р2O5 обрабатывают нагретым до 200° С концентрированным раствором H3PO4.
Расплавленная H3PO4 и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например НClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот явялется реакция с нитратом серебра — образуется жёлтый осадок:
- Н3РО4 + 3AgNO3 = Ag3PO4 + 3HNO3
Качественной реакцией на ион РО43- является образование ярко-жёлтого осадка молибденофосфата аммония:
- H3PO4 + 12(NH4)2MoO4 + 2HNО3 = (NH4)3PMo12O40·6H2O + 21NH4NO3 + 6Н2О
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
- Н3РО4 + NaOH = NaH2PO4 + H2O (дигидрофосфат натрия)
- H3PO4 + 2NaOH = Na2HPO4 + 2H2O (гидрофосфат натрия)
- H3PO4 + 3NaOH = Na3PO4 + 3H2O (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
- NaH2PO4 = NaPO3 + H2O
- 2Na2HPO4 = Na4P2O7 + H2O
Фосфаты при прокаливании не разлагаются, исключение составляет (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. в звероводстве (в частности, при выращивании норок) используют выпойку р-ра ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
См. также
Источники
- Карапетьянц М.
 Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
Ссылки
- Фосфорная кислота: Общие сведения о фосфорной кислоте. История открытия и получения фосфорной кислоты. Физические и химические свойства.
- Ортофосфорная кислота: Значение и применение Фосфорной кислоты.
Wikimedia Foundation.
2010.
Кислота ортофосфорная
Применение
Получение: В промышленности ортофосфорную кислоту получают экстракционным (сернокислотным) или термическим способами. Экстракционный способ заключается в разложении фосфатов природных серной и фосфорной кислотами и последующим разделением на фильтрах образовавшейся кислоты и нерастворимого CaSO4. Термический способ основан на сжигании фосфора до фосфорного ангидрида P4O10 и гидратации последнего P4O10 + 6h3O = 4h4PO4.
Промышленная ортофосфорная кислота — важнейший полупродукт для производства фосфорных и комплексных удобрений и технических фосфатов, широко используется также для фосфатирования металлов, в качестве катализатора в органическом синтезе. Пищевая фосфорная кислота применяется для приготовления безалкогольных напитков, лекарств, зубных цементов и т.д.
Пищевая фосфорная кислота применяется для приготовления безалкогольных напитков, лекарств, зубных цементов и т.д.
Описание
| Синонимы | Фосфорная кислота, о-фосфорная кислота, ортофосфорная кислота |
|---|---|
| Международное название | Phosphoric acid, Orthophosphoric acid |
| Формула | h4PO4 |
| Молекулярная масса | 98,0 |
| ГОСТ | ГОСТ 10678-76 (термическая) ГОСТ 6552-80 |
| CAS | 7664-38-2 |
| EINECS | 231-633-2 |
| RTECS | TB6300000 |
| Код ТНВЭД | 2809200000 |
| Код ГНГ | 28092000 |
| Код ЕТСНГ | 48128 |
Физико-химические свойства
Разлагается ниже температуры кипения при 213°C
| Температура плавления: | 21°C |
|---|---|
| Плотность: | 1. 69 г/см3 69 г/см3 |
| Растворимость в воде: | очень хорошая |
| Давление паров, Па при 20°C: | 4 |
Фасовка
Канистра 35 кг. Канистра 50 кг. IBC-куб 1000 л.
Хранение
Упаковка: канистры по 35 кг, 50 кг, бочки по 330 кг., IBC-контейнеры 1000 л., ТАНК-контейнеры 26 тонн
Страна производитель: Китай, Тайвань, Чехия, Германия, Израиль.
Ортофосфорная кислота, производство — Казахстан
| Наименование параметров | Нормы | |
|---|---|---|
| Техническая | Пищевая | |
| Внешний вид | Бесцветная или со слабым желтым оттенком жидкость в слое 15-20 мм при рассматривании на белом фоне | Бесцветная жидкость в слое 15-20 мм при рассматривании на белом фоне |
| Ортофосфорной кислоты (Н3РО4), %, не менее | 73 | 73 |
| Хлоридов, %, не более | 0,01 | 0,005 |
| Сульфатов, %, не более | 0,015 | 0,010 |
| Нитратов, %, не более | 0,0005 | 0,0003 |
| Железа (Fe), %, не более | 0,010 | 0,005 |
| Тяжелых металлов сероводородной группы (Pb), %, не более | 0,002 | 0,0005 |
| Мышьяка (As), %, не более | 0,006 | 0,0001 |
| Восстанавливающих веществ в пересчете на (Н3РО3), %, не более | 0,2 | 0,1 |
| Метафосфорной кислоты (НРО3) | Отсутствие | Отсутствие |
| Взвешенных частиц, %, не более | Отсутствие | Отсутствие |
| Наличие желтого фосфора (Р4) | Не нормируется | Отсутствие |
++++
Нормы по ГОСТ 10678-76 Ортофосфорная кислота термическая
| Наименование параметров | Нормы по ГОСТ 10678-76 | Заявленные показатели продукции пр-ва Китай | |
|---|---|---|---|
| Техническая | Пищевая | ||
| Внешний вид | Бесцветная или со слабым желтым оттенком жидкость в слое 15-20 мм при рассматривании на белом фоне | Соответствует | |
| Ортофосфорной кислоты (Н3РО4), %, не менее | 73 | 73 | 75 |
| Хлоридов, %, не более | 0,01 | 0,005 | 0,0002 |
| Сульфатов, %, не более | 0,015 | 0,010 | 0,002 |
| Нитратов, %, не более | 0,0005 | 0,0003 | 0,0005 |
| Железа (Fe), %, не более | 0,010 | 0,005 | 0,0017 |
| Тяжелых металлов сероводородной группы (Pb), %, не более | 0,002 | 0,0005 | 0,0005 |
| Мышьяка (As), %, не более | 0,006 | 0,0001 | 0,0001 |
| Восстанавливающих веществ в пересчете на (Н3РО3), %, не более | 0,2 | 0,1 | 0,05 |
| Наличие метафосфорной кислоты (НРО3) | Отсутствие | Отсутствие | Отсутствие |
| Взвешенных частиц, %, не более | Отсутствие | Отсутствие | Отсутствие |
| Наличие желтого фосфора (Р4) | Не нормируется | Отсутствие | Не нормируется |
++++
Нормы по ТУ 2142-002-00209450-96 Кислота ортофосфорная улучшенная
| Наименование показателя | Норма | Заявленные показатели продукции пр-ва Китай |
|---|---|---|
| Внешний вид | Слабо-желтая или желтая жидкость | Прозрачная жидкость |
| Ортофосфорной кислоты, %, не менее | 73,0 | 75 |
| Сульфатов, %, не более | 0,35 | 0,002 |
| Железа (Fe), %, не более | 0,04 | 0,0017 |
| Тяжелых металлов сероводородной группы (РЬ), %, не более | 0,001 | 0,0005 |
| Мышьяка, % , не более | 0,0005 | 0,0001 |
| Фтористых соединений (F), %, не более | 0,005 | 0,005 |
| Трибутилфосфата, %, не более | 0,0005 | 0,0005 |
| Взвешенных частиц, %, не более | 0,05 | отсутствие |
++++
Нормы по ТУ 2142-001-00209450-95 Кислота ортофосфорная очищенная
| Наименование показателя | Норма для марки Т3 | Заявленные показатели продукции пр-ва Китай |
|---|---|---|
| Внешний вид | Слабо-желтая или желтая жидкость | Прозрачная жидкость |
| Ортофосфорной кислоты, %, не менее | 73,0 | 75 |
| Сульфатов, %, не более | 0,3 | 0,002 |
| Железа (Fe), %, не более | 0,04 | 0,0017 |
| Фтористых соединений (F), %, не более | 0,05 | 0,005 |
| Трибутилфосфата, %, не более | 0,005 | 0,0005 |
| Взвешенных частиц, %, не более | 0,1 | отсутствие |
++++
Нормы по ГОСТ 6552-80 Кислота ортофосфорная 85%
| Наименование показателя | Норма по ГОСТ 6552-80 Чистый ( ч. ) ) | Заявленные характеристики продукции пр-ва Китай. |
|---|---|---|
| Внешний вид и цвет | Бесцветная прозрачная жидкость | Бесцветная прозрачная жидкость |
| Ортофосфорной кислоты (H3PO4), %, не менее | 85 | 85.3 |
| Плотность, г/см3, не менее | 1.69 | 1.69 |
| Остатка после прокаливания,% не более | 0.2 | 0.2 |
| Летучих кислот (CH3COOH),% не более | 0.0015 | 0.0015 |
| Нитратов (NO3),% не более | 0.0005 | 0.0005 |
| Сульфатов (SO4),% не более | 0.003 | 0.002 |
| Хлоридов (Cl),% не более | 0. 0003 0003 | 0.0002 |
| Аммонийных солей (NH4),% не более | 0.002 | 0.002 |
| Железа (Fe),% не более | 0.002 | 0.0017 |
| Мышьяка (As),% не более | 0.0002 | 0.00004 |
| Тяжелых металлов (Pb),% не более | 0.001 | 0.0005 |
| Веществ, восстанавливающих KMnO4 (H3PO3),% не более | 0.05 | 0.05 |
++++
Дополнительно
Таблица свойств растворов H3PO4 в зависимости от концентрации
Фосфорные кислоты с содержанием фосфорного ангидрида P2O5 в количествах, превышающих 68%, называются полифосфорными. При концентрациях выше 95% h4PO4 (68% P2O5) фосфорная кислота содержит смесь орто-, пиро-, три-, тетра- и более концентрированных фосфорных кислот с общей формулой H(n+2)PnO(3n+1). Концентрацию полифосфорной кислоты принято выражать в условном содержании в ней H3PO4, которое в процентном выражении может превышать 100%. Полифосфорная кислота представляет собой достаточно густую при комнатной температуре жидкость, которая при разбавлении водой с выделением тепла полностью переходит в ортофосфорную кислоту. Фосфорная кислота в большинстве случаев остается жидкой при температурах ниже точки замерзания и находится в виде переохлажденной жидкости.
Концентрацию полифосфорной кислоты принято выражать в условном содержании в ней H3PO4, которое в процентном выражении может превышать 100%. Полифосфорная кислота представляет собой достаточно густую при комнатной температуре жидкость, которая при разбавлении водой с выделением тепла полностью переходит в ортофосфорную кислоту. Фосфорная кислота в большинстве случаев остается жидкой при температурах ниже точки замерзания и находится в виде переохлажденной жидкости.
Свойства фосфорных и полифосфорных кислот
| Концентрация фосфорной (полифосфорной) кислоты | 75% | 85% | 95% | 105% | 115% |
|---|---|---|---|---|---|
| Внешний вид | Прозрачная жидкость | Прозрачная вязкая жидкость | |||
| Содержание P2O5 | 54,3 | 61,6 | 68,8 | 76,1 | 83,3 |
| Плотность, кг/л | 1,56 | 1,69 | 1,79 | 1,93 | 2,05 |
| Вязкость при 25°С , cP | 4 | 20 | 100 | 840 | 35000 |
| Вязкость при 100°С , cP | — | — | — | 35 | 800 |
| Температура плавления, °С | -17,5 | 21 | 25-30 | 16-30 | Ниже 0 |
| H3PO4, % | 100 | 100 | 97 | 51 | 5 |
| H4P2O7, % | — | — | 3 | 42 | 16 |
| H5P3O10, % | — | — | — | 6 | 17 |
| H6P4O13, % | — | — | — | 1 | 16 |
Более конц. кислоты, % кислоты, % | — | — | — | — | 46 |
Таблица свойств растворов H3PO4 в зависимости от концентрации
| Содержание, % по массе | T. затв., °C | T. кип., °C | Cp°, кДж/(кг·К) | n, Па·с (25 °C) | Уд. электрич. проводимость, См/м (25 0C) | Давление пара, Па (25 0C) | |
|---|---|---|---|---|---|---|---|
| h4PO4 | P2O5 | ||||||
| 5 | 3,62 | 0,8 | 100,10 | 4,0737 | 0,0010 | 10,0 | 3129,1 |
| 10 | 7,24 | -2,10 | 100,20 | 3,9314 | 0,0011 | 18,5 | 3087,7 |
| 20 | 14,49 | -6,00 | 100,80 | 3,6467 | 0,0016 | 18,3 | 2986,4 |
| 30 | 21,73 | -11,80 | 101,80 | 3,3411 | 0,0023 | 14,3 | 2835,7 |
| 40 | 28,96 | -21,90 | 103,90 | 3,0271 | 0,0035 | 11,0 | 2553,1 |
| 50 | 36,22 | -41,90 | 104,00 | 2,7465 | 0,0051 | 8,0 | 2223,8 |
| 60 | 43,47 | -76,9 | 114,90 | 2,4995 | 0,0092 | 7,2 | 1737,1 |
| 70 | 50,72 | -43,00 | 127,10 | 2,3278 | 0,0154 | 6,3 | 1122,6 |
| 75 | 54,32 | -17,55 | 135,00 | 2,2692 | 0,0200 | 5,8 | 805,2 |
Фосфорная кислота — использование и свойства фосфорной кислоты и ее применение
Фосфорная кислота, также называемая ортофосфорной кислотой, представляет собой слабую кислоту с химическим составом H 3 PO 4 .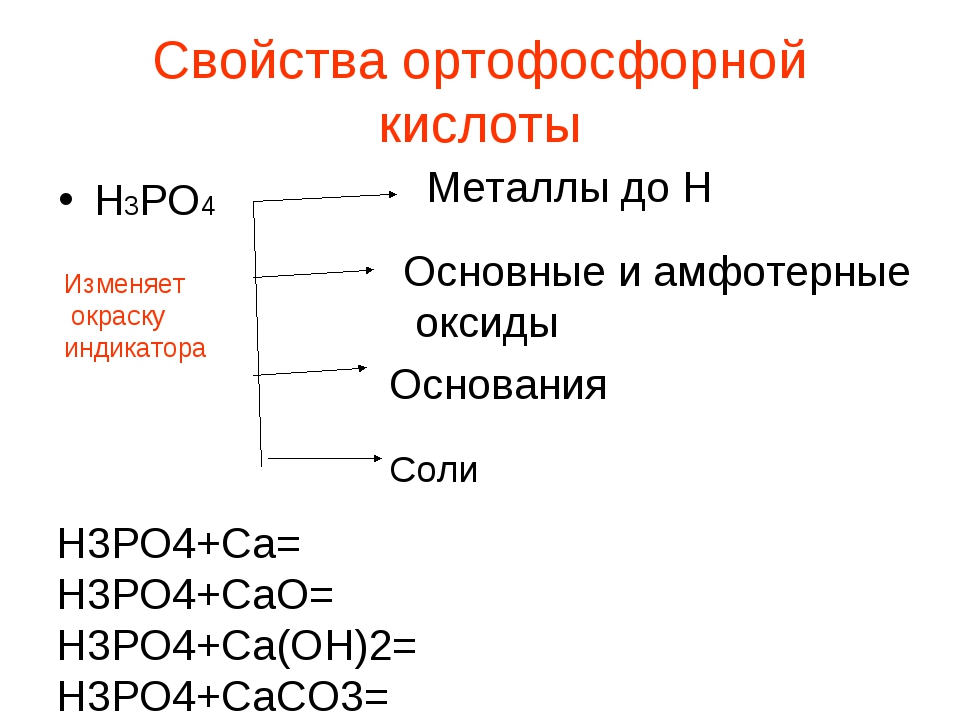 Ортофосфорная кислота называется фосфорной кислотой, что является термином ИЮПАК для этого соединения. Приставка орто- используется для дифференциации кислоты от связанных фосфорных кислот, известных как полифосфорные кислоты. Ортофосфорная кислота по своей природе является нетоксичной кислотой, которая в чистом виде является твердым веществом при комнатной температуре и давлении.Основанием конъюгата фосфорной кислоты является ион дигидрофосфата, H 2 PO -4 , который, в свою очередь, содержит сопряженное основание гидрофосфата, HPO 2 -4 , которое также содержит сопряженное основание фосфата. , А / я 3 -4 . Фосфаты жизненно необходимы.
Ортофосфорная кислота называется фосфорной кислотой, что является термином ИЮПАК для этого соединения. Приставка орто- используется для дифференциации кислоты от связанных фосфорных кислот, известных как полифосфорные кислоты. Ортофосфорная кислота по своей природе является нетоксичной кислотой, которая в чистом виде является твердым веществом при комнатной температуре и давлении.Основанием конъюгата фосфорной кислоты является ион дигидрофосфата, H 2 PO -4 , который, в свою очередь, содержит сопряженное основание гидрофосфата, HPO 2 -4 , которое также содержит сопряженное основание фосфата. , А / я 3 -4 . Фосфаты жизненно необходимы.
Наиболее распространенная форма фосфорной кислоты — 85% жидкий раствор; эти растворы бесцветны, нелетучие и без запаха. 85% раствор — густая жидкость, но все же переносимая.Несмотря на то, что фосфорная кислота не соответствует строгому значению сильной кислоты, 85% раствор достаточно кислый, чтобы быть жестким.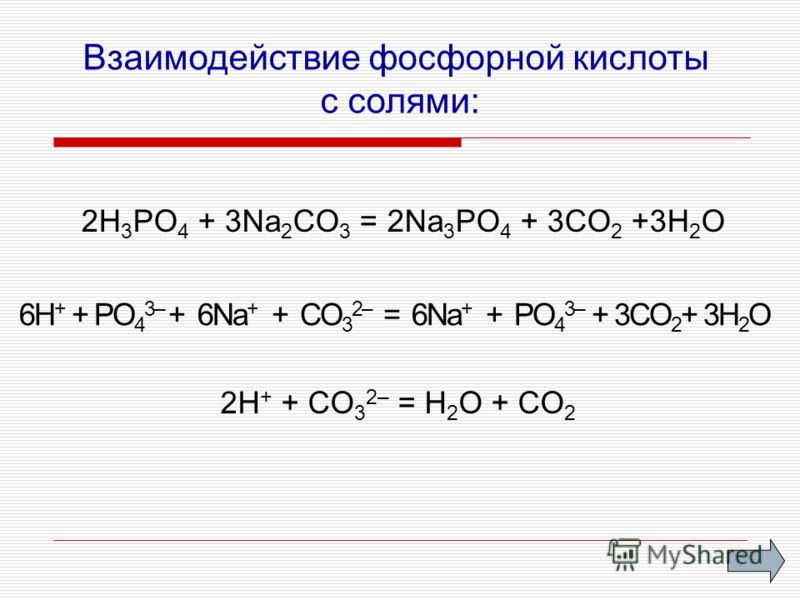
Физические свойства: Чистая фосфорная кислота представляет собой белое кристаллическое твердое вещество с температурой плавления 42,35 ° C. В менее плотном состоянии это бесцветная вязкая жидкость без запаха с плотностью 1,885 г / мл. Он нетоксичен и нелетучим по своей природе. Наиболее часто используемая концентрация фосфорной кислоты составляет 85% в воде H 2 O.
Химические свойства: фосфорная кислота имеет три кислых замещаемых атома водорода.Следовательно, он реагирует иначе, чем другие минеральные кислоты. Он может реагировать с основаниями с образованием трех классов солей путем замещения одного, двух или трех атомов водорода, таких как Na 2 HPO 4 , NaH 2 PO 4 и Na 3 PO 4 , отдельно.
При высоких температурах молекулы фосфорной кислоты могут реагировать вместе и объединяться с образованием димеров, триммеров и даже длинных полимерных цепочек или серий, таких как метафосфорные кислоты и полифосфорные кислоты
2 H 3 PO 4 → H 4 P 2 O 7 (ангидрид фосфорной кислоты)
Производство
Фосфорную кислоту производят промышленным способом двумя основными способами.
Фторапатит представляет собой замещающее сырье, в этом случае фторид удаляется как нерастворимое соединение Na2SiF6. Раствор фосфорной кислоты обычно содержит 25–35% P 2 O 5 (32–46% h4PO4). Его можно сконцентрировать для получения фосфорной кислоты товарной чистоты, которая содержит около 55–63% P 2 O 5 (76–86% H 3 PO 4 ). Дальнейшее удаление воды дает суперфосфорную кислоту с концентрацией P 2 O 5 выше 80% (что эквивалентно почти 100% H 3 PO 4 ).Сульфат кальция (гипс) образуется как побочный продукт и удаляется в виде фосфогипса.
Фосфорная кислота, полученная в результате обеих процедур, может быть дополнительно очищена путем удаления соединений мышьяка и других, возможно, токсичных примесей.
Мокрый процесс
Фосфорная кислота производится из фторапатита, называемого фосфоритом, 3Ca 3 (PO 4 ) 2 . CaF 2 , путем добавления концентрированной (95%) серной кислоты в цепь реакторов с хорошим перемешиванием.В результате образуется сульфат кальция (гипс) и фосфорная кислота, а также другие нерастворимые примеси. добавляется вода, и гипс удаляется фильтрацией вместе с другими нерастворимыми веществами (например, кремнеземом). Фторид, как H 2 SiF 6 , удаляется на следующей стадии испарением.
CaF 2 , путем добавления концентрированной (95%) серной кислоты в цепь реакторов с хорошим перемешиванием.В результате образуется сульфат кальция (гипс) и фосфорная кислота, а также другие нерастворимые примеси. добавляется вода, и гипс удаляется фильтрацией вместе с другими нерастворимыми веществами (например, кремнеземом). Фторид, как H 2 SiF 6 , удаляется на следующей стадии испарением.
Хотя реакция протекает поэтапно, включая дигидрофосфат кальция, общую реакцию можно записать как:
Ca 3 (PO 4 ) 2 (s) + 3H 2 SO 3 (I ) —> 2H 3 PO 4 (I) + 3CaSO 4 (s)
С другой стороны, есть побочные реакции; например, с карбонатом кальция и фторидом кальция, присутствующими в породе:
3CaF 2 (s) + SiO 2 (s) + 3H 2 SO 4 —> H 2 SiF 6 (I) + 3CaSO 4 (s) + 2H 2 O (I)
CaCO 3 (s) + H 2 SO 4 (I) —> CaSO 4 (s) + H 2 O (I) + CO 2 (g)
Кремнефтористоводородная кислота является жизненно важным побочным продуктом при этом и при производстве фтороводорода.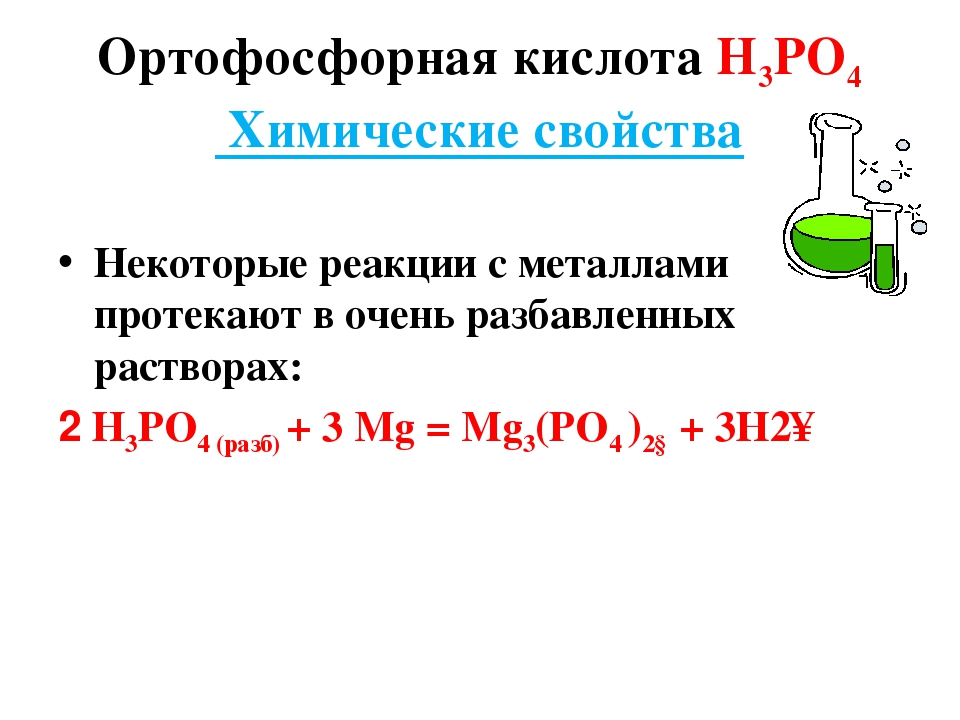 Его можно нейтрализовать гидроксидом натрия с получением гексофторосиликата натрия. Кислота также используется для производства фторида алюминия, который, в свою очередь, используется в производстве алюминия.
Его можно нейтрализовать гидроксидом натрия с получением гексофторосиликата натрия. Кислота также используется для производства фторида алюминия, который, в свою очередь, используется в производстве алюминия.
Структура горного кристалла образования сульфата кальция зависит от условий реакции. При 345-355 K основным выходом является дигидрат CaSO 4 .2H 2 O. При 368-388 K образуется полугидрат CaSO 4 ,1 / 2H 2 O.
Кальций. сульфат отфильтровывают, а затем кислоту концентрируют примерно до 56% P 2 O 5 с использованием вакуумной перегонки.
Кислота, полученная в результате «мокрого процесса», загрязнена, но может быть использована без дополнительной очистки для производства удобрений. Вместо этого он может быть испарен до 70% P 2 O 5 , раствора, известного как суперфосфорная кислота, который используется прямо как жидкое удобрение.
Для производства промышленных фосфатов кислоту фильтруют экстракцией растворителем, например, метилизобутилкетоном (MIBK), в котором кислота до некоторой степени растворима и концентрируется с получением 68% содержания P 2 O 5 .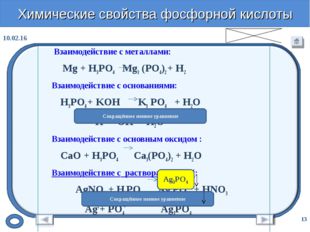 Эта кислота может быть дополнительно очищена с использованием растворителей для извлечения ее из тяжелых металлов и дефторирована (испарением) для создания продукта пищевого качества.
Эта кислота может быть дополнительно очищена с использованием растворителей для извлечения ее из тяжелых металлов и дефторирована (испарением) для создания продукта пищевого качества.
Термический процесс
Сырьем для этой процедуры являются воздух и фосфор:
P 4 (I) + 5O 2 (г) —> 2P 2 O 5 (г )
Первоначально фосфор распыляется в нагреватель и сжигается на воздухе в течение примерно 1850-3050 К.
В большинстве методов используется влажный воздух, а некоторые включают добавление пара в фосфорное пламя для получения и сохранения пленки сжатые полифосфорные кислоты, защищающие башню горелки из нержавеющей стали.Продукты из башни горелки направляются непосредственно в башню гидратации (используется вода), где газообразный оксид фосфора абсорбируется в виде фосфорной кислоты:
P 2 O 5 (г) + 3H 2 O ( I) —> 2H 3 PO 4 (I)
Фосфор можно сжигать в сухом воздухе. Пятиокись фосфора конденсируется в виде белого порошка и заметно гидратируется до фосфорной кислоты. Этот метод позволяет рекуперировать и повторно использовать тепло. Горение и прямая гидратация, как было определено ранее, создают высококоррозионные среды.Аппарат изготавливается из нержавеющей стали или облицован углеродным кирпичом. Для уменьшения коррозии стенки башен горелки и гидратора охлаждаются водой, но выход реактора выходит при температуре, слишком низкой для полезного извлечения тепла. Выход кислоты имеет концентрацию 85%. тетрафосфорная кислота, одна из группы полифосфорных кислот, которые можно производить селективно, образуется либо путем кипячения воды при высоких температурах в углеродном контейнере, либо путем добавления твердого пентоксида фосфора к почти кипящей фосфорной кислоте.Первый метод обычно дает более чистый выход из-за высокой концентрации мышьяка в пятиокиси фосфора.
Фосфаты
Соли фосфорной кислоты — это соединения, которые широко используются в сельском хозяйстве, промышленности и в быту.
(a) Фосфаты аммония
гидрофосфат диаммония и дигидрофосфат моноаммония, которые широко используются в качестве удобрений и получают путем смешивания необходимого количества фосфорной кислоты с безводным аммиаком во вращающемся барабане.Выбор фосфата аммония для использования зависит от количества азота и фосфора, необходимого для выращивания.
(б) Фосфаты кальция
Фосфаты кальция широко используются в качестве удобрений. Дигидрофосфат кальция, Ca (H 2 PO 4 ) 2 , производится реакцией серной кислоты с фосфатной рудой:
Ca 3 (PO 4 ) 2 + H 2 SO 4 —> Ca (H 2 PO 4 ) 2 + 2 CaSO 4
Это называется суперфосфатом.Он содержит около 20% P 2 O 5 . Если кристалл фосфата реагирует с фосфорной кислотой, отличной от серной, образуется более интенсивная форма дигидрофосфата кальция с общим более высоким уровнем P 2 O 5 (55%):
Ca 3 (PO 4 ) 2
Структура, химическая формула и свойства фосфорной кислоты
Фосфорная кислота — это химическое вещество, которое широко используется в самых разных областях.Вот более подробная информация о структуре, химической формуле и использовании фосфорной кислоты.
Знаете ли вы?
Наряду с угольной кислотой фосфорная кислота является неорганической кислотой, наиболее потребляемой человеком. Он используется в различных продуктах для придания кислого вкуса, в том числе в некоторых газированных напитках.
Хотите написать для нас? Что ж, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
Фосфорная кислота — это неорганическая или минеральная кислота с химической формулой H 3 PO 4 .Он также известен как ортофосфорная кислота . Его название в ИЮПАК на самом деле тригидроксидооксидофосфор фосфорная кислота, но, к счастью, так ее практически никогда не называли.
Он может быть образован двумя процессами; влажный и термический. Первый более распространен и дает менее чистую форму фосфорной кислоты, приемлемую для промышленного использования. Для применения в пищевой или косметической промышленности более чистые формы получают термическим методом. Наиболее часто используемая реакция для мокрого процесса представлена ниже.Содержание P 2 O 5 в продукте этого метода может варьироваться от 25% до 70%.
Ca 5 (PO 4 ) 3 X + 5H 2 SO 4 + 10H 2 O ➙ 3H 3 PO 4 + 5CaSO 4 2 .2H4 O + HX
«X» в этой реакции может быть галогенидом (F —, Cl —, Br —) или гидроксидом (OH —) ионом.
Термический процесс получения фосфорной кислоты состоит из растворения пентоксида фосфора в разбавленной фосфорной кислоте.Это дает очень чистую форму фосфорной кислоты, которую можно использовать для более чувствительных применений, но требует элементарного белого фосфора, который может быть трудно получить.
Структура
Атом фосфора в молекуле фосфорной кислоты связан с 4 атомами кислорода, один — двойной связью, а остальные три — одинарными. Атомы кислорода с одинарной связью дополнительно связаны с одним атомом водорода каждый, таким образом удовлетворяя их валентность. Атомы кислорода с одинарной связью сгруппированы гораздо ближе друг к другу, чем любой из них к атому кислорода с двойной связью.Трехмерная структура фосфорной кислоты представлена ниже.
Вот двухмерная версия структуры для облегчения понимания.
Недвижимость
- Как упоминалось ранее, чистая безводная фосфорная кислота в нормальных условиях представляет собой белое кристаллическое твердое вещество. Он плавится при температуре 108,2 ° F (42,35 ° C) и кипит (разлагается) при температуре 316,4 ° F (158 ° C).
- Он имеет плотность 2,03 г / мл в твердом состоянии и 1.685 г / мл в наиболее часто используемой форме 85% раствора.
- Он обладает редким свойством неорганической кислоты, которая может образовывать цепочки из собственных молекул. Эти реакции, обычно протекающие при высокой температуре и объясняющие потерю молекул воды, образуют классы фосфорных кислот, известных как пирофосфорная и метафосфорная кислоты.Общая формула этих соединений, соответственно, H (HPO 3 ) n OH и (HPO 3 ) n , где n = 3,4,5….
- Метафосфорная кислота представляет собой твердое стеклообразное вещество и представляет собой наиболее обезвоженную форму фосфорной кислоты, которую можно получить при простом нагревании. Его часто используют как дегидратирующий агент, поскольку он становится очень гигроскопичным (притягивается к воде). Только очень сильный осушитель превратит метафосфорную кислоту в пятиокись фосфора.
Хотите написать для нас? Что ж, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
Использует
► Фосфорная кислота, вероятно, является наиболее часто используемой минеральной кислотой.Большая его часть (около 90%) используется при производстве фосфорных удобрений.
► В разбавленной форме нетоксичен, поэтому он используется во многих пищевых продуктах. Он в основном используется во многих газированных напитках из-за его кислого вкуса. Он широко доступен и дешевле в производстве, чем органические заменители, такие как лимонная или яблочная кислота.
► Используется в стоматологии для очистки и придания шероховатости поверхности зуба, на который собирается пломбировать.
► В одном из менее распространенных применений он также может использоваться для удаления и в определенной степени противодействия коррозии. Он реагирует с оксидами железа с образованием фосфата железа. Его можно легко стереть или даже оставить на поверхности в качестве умеренной защиты от дальнейшей коррозии.
► Используется в качестве регулятора pH в некоторых отраслях промышленности. В гидропонике используется фосфорная кислота для снижения pH раствора, с двойным преимуществом, заключающимся в том, что фосфор способствует росту растений, особенно цветению.Он также используется в косметических продуктах для противодействия щелочным компонентам.
Фосфорная кислота | 7664-38-2
Фосфорная кислота Химические свойства, использование, производство
Описание
Фосфорная кислота была впервые получена Робертом Бойлем в 1694 году путем растворения пятиокиси фосфора в воде. Фосфорная кислота, вероятно, является наиболее важным соединением фосфора. Это второй по объему неорганический химический продукт после серной кислоты, продаваемый в Соединенных Штатах.
Наиболее важным применением фосфорной кислоты является производство фосфатных солей для удобрений. Такие фосфаты удобрений включают фосфаты натрия, кальция, аммония и калия. Другие области применения — травление металлов и обработка поверхности для удаления оксидов металлов с металлических поверхностей; электрополировка алюминия; в качестве связующего в различных огнеупорных продуктах, таких как оксид алюминия и магнезия; как катализатор при производстве нейлона и бензина; как дегидратирующий агент; в противопожарной защите дерева и тканей; в литографической гравюре; в крашении текстиля; в стоматологическом цементе; в коагулирующем каучуковом латексе; в очистке перекиси водорода; и как лабораторный реактив.Разбавленные растворы фосфорной кислоты используются в качестве добавок к газированным напиткам для приятного кислого вкуса. Также разбавленная кислота используется при рафинировании сахара; как питательное вещество; и как буферный агент при приготовлении джема, желе и антибиотиков. Коммерческая фосфорная кислота имеет концентрацию 85% (мас. / Мас.).
Химические свойства
Фосфорная кислота — это бесцветное кристаллическое твердое вещество без запаха или густая сиропообразная жидкость. Физическое состояние зависит от прочности и температуры.
Концентрированная фосфорная кислота представляет собой сиропообразную жидкость без цвета и запаха.При подходящем разбавлении он имеет приятный кисловатый вкус.
Чистая фосфорная кислота, также называемая ортофосфорной кислотой, представляет собой прозрачную бесцветную минеральную кислоту умеренной силы. Обычно он продается как водный раствор с концентрацией 75–85%, в котором он существует в виде прозрачной вязкой жидкости.
Пищевая фосфорная кислота используется для подкисления пищевых продуктов и напитков. Он придает острый или кислый вкус и, будучи массовым химическим продуктом, доступен дешево и в больших количествах. Фосфорная кислота, используемая во многих безалкогольных напитках, согласно эпидемиологическим исследованиям, снижает плотность костной ткани.Короче говоря, фосфорная кислота — это сильная кислота и обычное промышленное химическое вещество, используемое в производстве широкого ряда продуктов, особенно чистящих средств для фарфора и металлов, моющих средств и удобрений. Он также используется в качестве пищевой добавки и является основным компонентом многих безалкогольных напитков. Низкие концентрации фосфатов обнаруживаются в питьевой воде, в которую они добавляются в некоторых областях, чтобы снизить растворимость свинца.
Физические свойства
Химики называют ортофосфорную кислоту фосфорной.
кислота, которая является названием этого соединения ИЮПАК.В
приставка «орто» используется для отличия кислоты от других
фосфорные кислоты, которые обычно называют полифосфорными
кислоты. Ортофосфорная кислота нетоксична, скорее
слабая трипротонная кислота. В чистом виде это твердое вещество на STP.
Ортофосфорная кислота — очень полярная молекула, которая
делает его хорошо растворимым в воде. Валентное состояние
фосфор в ортофосфорной кислоте и других фосфорных
кислоты +5. Трипротический означает, что ортофосфорный
молекула кислоты может диссоциировать до трех раз,
с образованием катиона водорода H + каждый раз.
Происшествие
Фосфорная кислота — естественный компонент многих фруктов и их соков.
История
Фосфорная кислота производилась, но не была идентифицирована алхимиками в древние времена. Он получил свое название от элемента фосфор, который был открыт в 1669 году Хеннингом Брэндом (1630-1710). Впоследствии Шил выделил фосфор из костной золы и произвел фосфорную кислоту путем взаимодействия фосфора и азотной кислоты. Метод Шееле заменил кость в качестве основного источника фосфора, а не мочу.
Джон Беннетт Лоуз (1814-1900) в 1841 году запатентовал процесс получения суперфосфата из костей, а затем распространил свой процесс на фосфаты, полученные из горных пород. Суперфосфаты производятся обработкой Ca3 (PO4) 2 серной кислотой для получения более растворимых гидрофосфатов кальция: Ca3 (PO4) 2 + 2h3SO4 Ca (h3PO4) 2 + 2CaSO4. В этой реакции Ca (h3PO4) 2 представляет собой одноосновный фосфат кальция, который также называют суперфосфатом. Гидрофосфаты кальция (суперфосфаты) более растворимы в воде и поэтому более доступны для растений.
использует
Фосфорная кислота уступает только серной кислоте в качестве промышленной кислоты и неизменно входит в десятку ведущих химических веществ, используемых во всем мире, в штатах, но используется в ряде других областей. Фосфаты использовались в качестве добавок и смягчителей воды. Добавка — это вещество, добавляемое в мыло или моющие средства для увеличения их очищающей способности.
Фосфорная кислота используется в качестве промежуточного продукта в производстве добавок к корму для животных, химикатов для обработки воды, обработки металлических поверхностей, травильных агентов и средств личной гигиены, таких как зубная паста.Он используется в качестве катализатора в нефтяной и полимерной промышленности. Фосфорная кислота используется в пищевых продуктах как консервант, подкислитель и усилитель вкуса; он подкисляет газированные напитки, такие как кока-кола и пепси, придавая им пикантный вкус. Фосфорная кислота используется как средство для удаления корки и очистителя металлов. Naval Jelly содержит примерно 25% фосфорной кислоты. Другие применения фосфорной кислоты включают контроль непрозрачности при производстве стекла, крашение текстиля, коагуляцию латексной резины и стоматологические цементы.
использует
Фосфорная кислота (H 3 PO 4 ) является наиболее важной оксокислотой фосфора и в основном используется в производстве удобрений.
В организме человека фосфат является основным фосфорсодержащим соединением. Фосфат — это неорганическое соединение и соль фосфорной кислоты. Он может образовывать сложные органические эфиры с различными соединениями, которые играют важную роль во многих биохимических процессах. Фосфат имеет эмпирическую формулу PO 4 3-. Это тетраэдрическая молекула, в которой центральный атом фосфора окружен четырьмя атомами кислорода.
В биологических системах фосфат часто встречается либо в виде свободного иона (неорганический фосфат), либо в виде сложного эфира после реакции с органическими соединениями (часто называемыми органическими фосфатами).Неорганический фосфат (в основном обозначаемый Pi) представляет собой смесь HPO 4 2- и H 2 PO 4 — при физиологическом pH.
использует
При производстве суперфосфатов для удобрений, других фосфатных солей, полифосфатов, моющих средств. Кислотный катализатор при производстве этилена, очистке перекиси водорода. Как подкислитель и ароматизатор, синергетический антиоксидант и секвестрант в пище. Фармацевтическое средство (растворитель). В стоматологических цементах; технологическая гравировка; антикоррозийная обработка металлов перед покраской; коагулирующий каучуковый латекс; как аналитический реагент.
использует
Фосфорная кислота — это подкислитель, представляющий собой неорганическую кислоту.
сжигая фосфор в избытке воздуха, образуя фосфор
пентоксид, который растворяется в воде с образованием ортофосфорной кислоты
различной концентрации. это сильная кислота, растворимая в
вода. кислые соли называются фосфатами. он используется как ароматизатор
кислоты в напитках из колы и корневого пива для обеспечения желаемой кислотности и
кислинка. он используется как синергетический антиоксидант в овощном шортенинге —
ings.в производстве дрожжей он используется для поддержания кислотного pH и
обеспечивают источник фосфора. он также действует как подкислитель в
сыр. ее также называют ортофосфорной кислотой.
Определение
ChEBI: оксикислота фосфора, состоящая из одной оксо и трех гидроксильных групп, ковалентно связанных с центральным атомом фосфора.
Препарат
Техническая фосфорная кислота низкой чистоты для использования в удобрениях производится из фосфатных пород путем разложения концентрированной серной кислотой.Используются типы апатита, в основном состоящие из фосфатно-фосфатных пород кальция: Ca3 (PO4) 2 + 3h3SO4 + 6h3O → 2h4PO4 + 3 (CaSO4 • 2h3O)
Нерастворимую суспензию сульфата кальция отфильтровывают. Кислота, полученная в результате этого мокрого процесса, является нечистой, но ее можно очистить различными методами. Этапы очистки включают методы осаждения, экстракции растворителем, кристаллизации и ионного обмена.
Фосфорную кислоту также можно получить разными способами. При растворении пятиокиси фосфора в воде и кипячении образуется фосфорная кислота.Чистую фосфорную кислоту можно получить сжиганием фосфора в смеси воздуха и пара:
P4 (л) + 5O2 (г) → P4O10 (т)
P4O10 (т) + h3O (г) → 4h4PO4 (л)
Кислота также может быть получена нагреванием фиолетового фосфора с 33% азотной кислотой:
4P + 10HNO3 + h3O → 4h4PO4 + 5NO ↑ + 5NO2 ↑
или нагреванием красного фосфора с азотной кислотой (1: 1). Общее уравнение:
P + 3HNO3 → h4PO4 + NO + 2NO2
Методы производства
Большая часть фосфорной кислоты производится путем переваривания фосфатов.
порода (в основном трикальцийфосфат) с серной кислотой; то
Затем фосфорную кислоту отделяют фильтрованием суспензии.Очищение
достигается путем химического осаждения, экстракции растворителем, кристаллизации,
или ионный обмен.
Методы производства
Основными источниками h4PO4 традиционно были месторождения фосфоритов. Добыча полезных ископаемых ведется во многих регионах, в том числе в США (Флорида), Средиземноморье и России. Основным компонентом большинства фосфатных пород является фторапатит 3Ca3 (PO4) 2 · CaF2. Поставки высококачественных фосфатов, предпочтительного сырья для производства высокочистой фосфорной кислоты мокрым способом, в некоторых областях быстро сокращаются.
Для производства фосфорной кислоты из фосфоритов используются два основных метода. Влажный процесс включает реакцию фосфатной породы с серной кислотой с образованием фосфорной кислоты и нерастворимых сульфатов кальция. Многие примеси, присутствующие в фосфатной руде, также солюбилизируются и удерживаются в полученной таким образом кислоте. Хотя они не представляют серьезного недостатка, когда кислота должна использоваться для производства удобрений, их присутствие делает продукт непригодным для приготовления фосфатных химикатов.
В другом методе, в печи, фосфатная руда объединяется с коксом и кремнеземом и восстанавливается при высокой температуре в электрической печи с последующей конденсацией элементарного фосфора. Фосфорная кислота производится путем сжигания элементарного фосфора с воздухом и поглощения P2O5 водой. Кислота, полученная этим методом, имеет высокую чистоту и подходит почти для всех применений с минимальной дополнительной обработкой или без нее.
фирменное наименование
Фармацевтическое средство (растворитель).
Общее описание
Прозрачная бесцветная жидкость или прозрачное кристаллическое твердое вещество. Чистое твердое вещество плавится при 42,35 ° C и имеет плотность 1,834 г / см3. Жидкость обычно представляет собой 85% водный раствор. Поставляется как в твердом, так и в жидком виде. Разъедает металлы и ткани. Используется при производстве удобрений и моющих средств, а также в пищевой промышленности.
Реакции воздуха и воды
Растворим в воде с небольшим выделением тепла.
Профиль реактивности
Фосфорная кислота экзотермически реагирует с основаниями.Может реагировать с активными металлами, включая такие структурные металлы, как алюминий и железо, с выделением водорода, горючего газа. Может инициировать полимеризацию некоторых классов органических соединений. Реагирует с цианистыми соединениями с выделением газообразного цианистого водорода. Может образовывать горючие и / или токсичные газы при контакте с дитиокарбаматами, изоцианатами, меркаптанами, нитридами, нитрилами, сульфидами и сильными восстановителями. Образует взрывоопасную смесь с нитрометаном. Интенсивно Реагирует с тетрагидроборатом натрия.В присутствии хлоридов нержавеющая сталь может вызывать коррозию с образованием взрывоопасного газообразного водорода. При нагревании до разложения выделяет токсичные и раздражающие пары оксидов фосфора [Lewis, 3 ed., 1993, p. 1029].
Опасность для здоровья
Фосфорная кислота менее агрессивна и опасна, чем концентрированная серная или азотная кислота. Его концентрированные растворы раздражают кожу и слизистые оболочки. Пары (пары P2O5) могут вызывать раздражение горла и кашель, но переносятся на 3.Сообщается, что острая пероральная токсичность у крыс низкая, значение LD50 составляет 1530 мг / кг (NIOSH 1986).
Пожарная опасность
Вещество негорючее, само по себе не горит, но может разлагаться при нагревании с образованием едких и / или токсичных паров. Некоторые из них являются окислителями и могут воспламенить горючие вещества (дерево, бумага, масло, одежда и т. Д.). При контакте с металлами может выделяться легковоспламеняющийся водород. Емкости могут взорваться при нагревании.
Использование в сельском хозяйстве
Фосфорная кислота (H 3 PO 4 ), также известная как ортофосфорная
кислота, является наиболее значительным источником
фосфорные удобрения.Удобрения на основе фосфорной кислоты
в основном включают фосфат аммония, диаммоний
фосфат и моноаммонийфосфат.
Фосфорная кислота обладает текучестью и коммерчески
важнейшее производное фосфора, составляющее
более 90% добытой фосфоритной руды. Белый
ромбическое твердое вещество хорошо растворяется в воде и этаноле, и
концентрированный водный раствор обычно доступен
для использования.
Фосфорная кислота используется в нескольких отраслях промышленности.
чем промышленность удобрений. Самый элементарный фосфор
превращается в фосфорную кислоту для использования не в качестве удобрений.Есть два основных процесса производства
фосфорная кислота.
Метафосфорная кислота получается нагреванием
фосфорной кислоты до появления густых белых паров.
Продукт обладает высокой текучестью и стеклянной
внешний вид. Его соли известны как метафосфаты.
Ортофосфорная кислота является наиболее распространенной и используется
как важный фосфатный ингредиент в коммерческих
удобрения.
Применение в фармацевтике
Фосфорная кислота широко используется в качестве подкисляющего агента в различных
фармацевтические составы.Используется в фармацевтических продуктах
как часть буферной системы в сочетании с фосфатной солью
такой как фосфат натрия, одноосновный или двухосновный. Также широко
используется в пищевых продуктах как подкислитель, ароматизатор и синергетик
антиоксидант (0,001–0,005%) и секвестрант.
С терапевтической точки зрения использовалась разбавленная фосфорная кислота.
в препаратах, используемых для лечения тошноты и
рвота. 35% гель фосфорной кислоты также использовался для травления
эмаль зубов и для улучшения доставки лекарств через ноготь.
)
Наноразмерный порошок гидроксиапатита был получен путем комбинирования
фосфорная кислота с яичной скорлупой.
Промышленное использование
В качестве очищающего средства для металлов фосфорная кислота образует легкое травление на стали, алюминии или цинке, что способствует адгезии краски. Деоксидин — это очищающее средство на основе фосфорной кислоты для металлов. Nielite D — это фосфорная кислота с ингибитором ржавчины, используемая в качестве не дымящей кислоты для травления стали. Альбрит доступен в концентрациях 75, 80 и 85% в пищевой и электронной промышленности, оба имеют высокую степень чистоты.DAB и Phosbrite называются сортами Bright Dip для очистки. Фосфорный ангидрид, или пятиокись фосфора, P2O5, представляет собой белый водорастворимый порошок, используемый в качестве дегидратирующего агента, а также в качестве опалубливателя для стекла. Он также используется в качестве катализатора в асфальтовых покрытиях для предотвращения размягчения при повышенных температурах и хрупкости при низких температурах.
Профиль безопасности
Человеческий яд при приеме внутрь. Умеренно токсично при контакте с кожей. Раздражает глаза, кожу и слизистые оболочки, а также является системным раздражителем при вдыхании.Обычный загрязнитель воздуха. Сильная кислота. Смеси с нитрометаном взрывоопасны. Реагирует с хлоридами + нержавеющая сталь с образованием взрывоопасного газообразного водорода. Потенциально бурная реакция с тетрагидроборатом раствора. Опасно; при нагревании до разложения выделяет токсичные пары POx
Безопасность
В концентрированном виде фосфорная кислота является чрезвычайно коррозионным веществом.
и вредная кислота. Однако при использовании в фармацевтических составах он обычно очень разбавлен и обычно рассматривается как
по существу нетоксичный и не вызывающий раздражения материал.
Самая низкая летальная пероральная доза концентрированной фосфорной кислоты в
у людей — 1286 мл / кг.
(кролик, кожа): 2,74 г / кг
(крыса, перорально): 1,53 г / кг
Химический синтез
Элементарный фосфор сжигается с образованием пентоксида фосфора (P2O5), который затем гидратируется. Жара тогда
удаляется, а фосфорная кислота (h4PO4) собирается в виде тонкого тумана. Еще один важный источник фосфорной кислоты — фосфаты.
горные породы обработкой серной кислотой; это так называемый влажно-кислотный процесс.Синтез чистой фосфорной кислоты включает несколько
этапы, включая трудоемкий и дорогостоящий этап — сублимацию белого фосфора.
Возможное облучение
Фосфорная кислота используется при производстве удобрений, фосфорных солей; полифосфаты, моющие средства, активированный уголь; корма для животных; керамика, стоматологический цемент; фармацевтические препараты, безалкогольные напитки; желатин, ингибиторы ржавчины; воск и латекс. Облучение также может происходить при электрополировке, гравировке, фотогравировке, литографии, очистке металла; рафинирование сахара; и водоочистка.
Канцерогенность
Фосфорная кислота не оказывает мутагенного
бактериальные анализы.
хранилище
При хранении при низкой температуре фосфорная кислота может затвердеть,
образование массы бесцветных кристаллов, содержащих полугидрат,
который плавится при 28 ° C. Фосфорную кислоту следует хранить в герметичном
емкость в прохладном сухом месте. Можно использовать емкости из нержавеющей стали.
Доставка
UN1805 Раствор фосфорной кислоты, Класс опасности: 8; Этикетки: 8-Коррозийный материал.UN3543 Фосфорная кислота твердая, Класс опасности: 8; Этикетки: 8-Коррозийный материал.
Несовместимость
Фосфорная кислота — сильная кислота, вступающая в реакцию с щелочными веществами.
Смеси с нитрометаном взрывоопасны.
Удаление отходов
Медленно добавить к раствору кальцинированной соды и гашеной извести при перемешивании, затем смыть в канализацию большим количеством воды.
Нормативный статус
В списке ГРАС. Принята в качестве пищевой добавки в Европе.Включено в
База данных неактивных ингредиентов FDA (настои, инъекции, пероральные
растворы, кремы для местного применения, лосьоны, мази и растворы, а также
вагинальные препараты). Включен в непарентеральный и парентеральный
лекарства лицензированы в Великобритании. Включен в Канадский список
Допустимые немедикаментозные ингредиенты.
Продукты и сырье для получения фосфорной кислоты
Сырье
Препараты
Фосфорная кислота
Фосфор является важным питательным веществом для растений и поглощается корнями растений, обычно в виде дигидрофосфат-иона, H 2 PO 4 — , полученного из фосфорной кислоты, H 3 PO 4 .Производство удобрений, которые используются для устранения дефицита фосфора в почвах, зависит от наличия запасов фосфорной кислоты.
Использование фосфорной кислоты
Около 90% производимой фосфорной кислоты используется для производства удобрений. Он в основном превращается в три фосфатные соли, которые используются в качестве удобрений. Это тройной суперфосфат (TSP), гидрофосфат диамония (DAP) и дигидрофосфат моноаммония (MAP).
Рис. 1 Использование фосфорной кислоты.
Данные Potash Corporation, 2014 г.
Фосфаты также используются множеством других способов, в том числе в безалкогольных напитках и в качестве добавок в корма для крупного рогатого скота, свиней и птицы.
Хотя их использование в качестве моющих добавок в моющих средствах было прекращено во многих странах, в некоторых странах они по-прежнему являются важным применением кислоты.
Годовое производство фосфорной кислоты
| Весь мир | 43 млн тонн 1,2,3 |
| Китай | 17 млн тонн 4 |
| Юго-Восточная и Северо-Восточная Азия (включая Индонезию и Японию) | 10 млн тонн 4 |
| США | 8.4 млн тонн 5 |
1 Potash Corporation, 2014
2 JDCPhosphate, 2014
3 Оценка на 2016 год
4 Экстраполировано на основе данных, IHS, Markit, 2015
5 Химический бизнес 2015, Американский химический совет, 2016
Производство фосфорной кислоты
Фосфорная кислота производится двумя способами:
а) «мокрый» процесс
б) термический процесс
Термический метод обычно дает более концентрированный и чистый продукт, но требует больших затрат энергии (из-за производства самого фосфора.Кислота, полученная «мокрым» способом, менее чиста, но используется при производстве удобрений.
(a) Мокрый процесс
Фосфорная кислота производится из фторапатита, известного как фосфатная руда, 3Ca 3 (PO 4 ) 2 .CaF 2 , путем добавления концентрированной (93%) серной кислоты в серию хорошо перемешанных реакторы. В результате образуется фосфорная кислота и сульфат кальция (гипс), а также другие нерастворимые примеси. Добавляется вода, и гипс удаляется фильтрацией вместе с другими нерастворимыми материалами (например,грамм. кремнезем). Фторид, как H 2 SiF 6 , удаляется на следующей стадии путем выпаривания.
Хотя реакция протекает поэтапно с участием дигидрофосфата кальция, общую реакцию можно представить как:
Однако есть побочные реакции; например, если в породе присутствуют фторид кальция и карбонат кальция:
Кремнефтористоводородная кислота является важным побочным продуктом при производстве фтороводорода.Его можно нейтрализовать гидроксидом натрия с образованием гексафторсиликата натрия. Кислота также используется для производства фторида алюминия, который, в свою очередь, используется при производстве алюминия.
Кристаллическая структура образовавшегося сульфата кальция зависит от условий реакции. При 340-350 K основным продуктом является дигидрат CaSO 4 .2H 2 O. При 360-380 K образуется полугидрат CaSO 4 . 1 / 2 H 2 O.
Сульфат кальция отфильтровывают, а затем концентрируют кислоту примерно до 56% P 2 O 5 , используя вакуумную перегонку.
Продукт, полученный в результате «мокрого процесса» кислоты, не чистый, но может быть использован без дополнительной очистки для производства удобрений (см. Ниже). В качестве альтернативы он может быть дополнительно выпарен до около 70% P 2 O 5 , раствора, называемого суперфосфорной кислотой, который используется непосредственно в качестве жидкого удобрения.
Для получения промышленных фосфатов кислоту очищают экстракцией растворителем, используя, например, метилизобутилкетон (MIBK), в котором кислота слабо растворима и концентрируется с получением 60% содержания P 2 O 5 . Эта кислота может быть дополнительно очищена с использованием растворителей для извлечения ее из тяжелых металлов и дефторирована (выпариванием) для получения продукта пищевого качества.
(б) Термический процесс
Сырьем для этого процесса являются фосфор и воздух:
Сначала фосфор распыляется в печь и сжигается на воздухе при температуре около 1800-3000 К.
В большинстве процессов используется неосушенный воздух, а многие включают добавление пара в фосфорную горелку для образования и поддержания пленки конденсированных полифосфорных кислот, которые защищают башню горелки из нержавеющей стали (внешнее водяное охлаждение). Продукты из башни горелки проходят непосредственно в башню гидратации, где газообразный оксид фосфора абсорбируется рециркулируемой фосфорной кислотой:
В качестве альтернативы можно сжигать фосфор в осушенном воздухе. Пятиокись фосфора конденсируется в виде белого порошка и отдельно гидратируется до фосфорной кислоты.
Этот метод позволяет восстанавливать и повторно использовать тепло.
Горение и прямая гидратация, как описано выше, создают сильно коррозионные условия. Оборудование изготовлено из нержавеющей стали или облицовано углеродным кирпичом. Чтобы уменьшить коррозию, стенки башни горелки и гидратора охлаждаются, но продукты реактора выходят при температуре, слишком низкой для полезной рекуперации тепла.
Кислота продукта имеет концентрацию около 85%.
Тетрафосфорная кислота, одна из семейства полифосфорных кислот, которую можно производить селективно, получают либо путем кипячения воды при высоких температурах в углеродном сосуде, либо путем добавления твердого пятиокиси фосфора к почти кипящей фосфорной кислоте.Первый метод обычно дает более чистый продукт из-за высокого содержания мышьяка в пятиокиси фосфора.
Фосфаты
Соли фосфорной кислоты, фосфаты, представляют собой соединения, которые широко используются в сельском хозяйстве, промышленности и в быту.
(а) Фосфаты аммония
Дигидрофосфат аммония и гидрофосфат диаммония широко используются в качестве удобрений и производятся путем смешивания фосфорной кислоты с безводным аммиаком в правильных пропорциях во вращающемся барабане.
Выбор фосфата аммония для использования зависит от пропорции азота и фосфора, необходимой для культуры.
(б) Фосфаты кальция
Фосфаты кальция широко используются в качестве удобрений. Дигидрофосфат кальция, Ca (H 2 PO 4 ) 2 , образуется при реакции фосфатной руды с серной кислотой:
Это известно как суперфосфат . Он содержит ок. 20% P 2 O 5 .
Если фосфоритную руду обрабатывают фосфорной кислотой, а не серной кислотой, образуется более концентрированная форма дигидрофосфата кальция с общим более высоким уровнем P 2 O 5 (50%):
Это известно как тройной суперфосфат . Более высокий уровень фосфата достигается, поскольку продукт больше не разбавляется сульфатом кальция.
(c) Фосфаты натрия
Фосфаты натрия получают реакцией фосфорной кислоты и концентрированного раствора гидроксида натрия в соответствующих (стехиометрических) пропорциях.Продукт выкристаллизовывается.
- Дигидрофосфат натрия (MSP, NaH 2 PO 4 ) используется в составах для очистки металлов и подготовки поверхности, в качестве источника фосфата в фармацевтическом производстве и в качестве агента контроля pH в зубных пастах, покрытии эмали стекловидного тела ( сантехника, ) и при производстве фосфатов крахмала. Одно из самых распространенных применений — обработка питьевой воды свинцом . Либо фосфорную кислоту, либо MSP можно использовать для получения тонкого нерастворимого покрытия из фосфата свинца на свинцовых трубах, чтобы предотвратить растворение свинца кислотами в воде.
- Гидрофосфат динатрия (Na 2 HPO 4 ) используется в качестве смягчающего агента в плавленом сыре, в эмалях и керамической глазури, при дублении кожи, при производстве красителей и в качестве ингибитора коррозии при очистке воды.
- Тринатрийфосфат (Na 3 PO 4 ) используется в чистящих средствах для тяжелых условий эксплуатации, например, при обезжиривании стали. Он является щелочью и связывает ионы кальция, удерживая их в растворе и предотвращая образование накипи.
- Пирофосфат натрия (Na 2 H 2 P 2 O 7 ) используется в качестве разрыхлителя в хлебе / пирожных (способствует высвобождению углекислого газа из пищевой соды), как оксид железа. подавитель (эффект потемнения или потемнения) при производстве различных пищевых продуктов и в качестве диспергатора в буровом растворе для нефтяных скважин.
Дата последнего изменения: 5 января 2017 г.
Фосфорная кислота — Sciencemadness Wiki
Фосфорная кислота — это минеральная кислота средней силы, имеющая химическую формулу H 3 PO 4 , которую более правильно назвать ортофосфорной кислотой , чтобы отличить ее от других фосфатов. содержащие кислоты.Ортофосфорная кислота является относительно нетоксичной кислотой, которая в чистом виде является твердым веществом при комнатной температуре и давлении. Однако он чрезвычайно расплывается, и его трудно выделить в виде твердого вещества, поэтому обычно используется вязкий 80-85% раствор, известный как концентрированная фосфорная кислота.
Недвижимость
Химическая промышленность
Степень окисления фосфора в орто- и других фосфорных кислотах +5. Кислота является трипротонной, что означает, что молекула ортофосфорной кислоты может диссоциировать до трех раз, каждый раз отдавая H + , который обычно соединяется с молекулой воды H 2 O.
Фосфорная кислота может использоваться для удаления ржавчины путем непосредственного нанесения на ржавое железо, стальные инструменты или другие поверхности. Фосфорная кислота превращает красновато-коричневый оксид железа (III) в фосфат железа, FePO 4 :
- 2 H 3 PO 4 + Fe 2 O 3 → 2 FePO 4 + 3 H 2 O
Смесь концентрированной фосфорной кислоты (иногда остаток от комбинации фосфат и серную кислоту можно использовать отдельно), а углерод можно нагреть до покраснения (не менее 1000 ° C) в реторте внутри печи для образования пара элементарного фосфора, который может конденсироваться под водой с образованием пригодного для использования белого фосфора.
Поскольку эта кислота особенно нелетучая, она может вытеснить даже более сильные кислоты из их солей при достаточном нагревании. Такие сильные кислоты, как иодистоводородная кислота, могут быть вытеснены из их солей фосфорной кислотой. Кроме того, он исключительно мягкий с точки зрения окислительно-восстановительного потенциала, он не склонен к окислению даже очень сильных восстановителей. Однако сообщается, что он разрушает стекло при нагревании выше 80-90 по Цельсию, особенно при высоких концентрациях, поэтому с помощью фосфорной кислоты можно получить только те кислоты, которые не повреждают стеклянную посуду, которая может выходить из реакционной колбы в газообразной форме ниже этой температуры.
Физическое
Ортофосфорная кислота — очень полярная молекула, смешивающаяся с водой. Чем более концентрированный раствор, тем более вязким и сиропообразным он становится, что приводит к образованию больших пузырьков при взаимодействии с выделяющими газ веществами, такими как карбонаты. Безводная фосфорная кислота, белое легкоплавкое твердое вещество, получают дегидратацией 85% фосфорной кислоты при осторожном нагревании в вакууме. Само по себе нагревание разлагает фосфорную кислоту. Одно только испарение высушит фосфорную кислоту до твердого дигидрата.
Наличие
Фосфорная кислота различных концентраций доступна в хозяйственных или ремонтных мастерских в виде средств для удаления ржавчины, чистящих средств для полов или травильных растворов. Концентрированная пищевая фосфорная кислота редко встречается в качестве добавки к напиткам. В некоторых странах 80-85% фосфорная кислота продается без рецепта в небольших флаконах в качестве паяльного флюса; эта кислота не требует очистки и может использоваться для экспериментов как есть.
Препарат
Фосфорная кислота производится промышленным способом двумя основными способами — термическим процессом и мокрым процессом, который включает два вспомогательных метода.В коммерческом секторе преобладает мокрый процесс. Более дорогой термический процесс позволяет получить более чистый продукт, который используется в пищевой промышленности.
мокрый
Фосфорная кислота, полученная влажным способом, получается путем добавления серной кислоты (или другой сильной кислоты) к трикальцийфосфатной породе, обычно встречающейся в природе в виде апатита, который также является основным компонентом кости. Реакция такая:
- Ca 5 (PO 4 ) 3 X + 5 H 2 SO 4 + 10 H 2 O → 3 H 3 PO 4 + 5 CaSO 4 · 2 ч 2 O + HX
- , где X может включать OH, F, Cl и Br.
Производство фосфорной кислоты этим методом предпочтительно должно осуществляться на открытом воздухе, поскольку может образовываться смертельно опасный фтористый водород и другие опасные побочные продукты.
Тепловой
Очень чистая фосфорная кислота получается путем сжигания фосфора с образованием пентоксида фосфора, который затем растворяется в разбавленной фосфорной кислоте или даже в простой воде, если у вас нет кислоты. Однако это следует делать очень осторожно, так как реакция сильно экзотермична и образуется мелкодисперсный туман высококоррозионной и опасной фосфорной кислоты, воды, пятиокиси фосфора. В качестве альтернативы можно использовать водяной пар.
Этот метод можно использовать для получения чистой (считываемой 100%) фосфорной кислоты путем добавления эквимолярного P 2 O 5 к воде в контролируемых условиях.
Проектов
- Сделать элементарный фосфор (белый)
- Сделать фосфаты металлов
- Преобразование ржавого покрытия на старом оборудовании в более устойчивый и привлекательный вид
- Синтез иодистоводородной кислоты
- Его также можно использовать для получения любой галогеноводородной кислоты (фактически, любой летучей кислоты)
Обращение
Безопасность
Как и многие более сильные минеральные кислоты, фосфорная кислота может вызывать химические ожоги при высоких концентрациях и раздражение или обезвоживание кожи при низких концентрациях.Образцы с очень высокой концентрацией могут содержать элементарный фосфор, который имеет свой собственный набор опасностей; это следует принять во внимание, прежде чем вступать в реакцию фосфорной кислоты с такими веществами, как металлы, которые могут вызвать образование фосфина.
Хранилище
Лучше всего хранить в закрытых бутылках из толстого пластика или стекла, вдали от влаги и аммиака.
Утилизация
Перед утилизацией фосфорную кислоту необходимо нейтрализовать гидроксидом или карбонатом кальция. Он не представляет угрозы для окружающей среды, поэтому его можно утилизировать практически везде.Его соли — хорошее удобрение.
Список литературы
Соответствующие темы Sciencemadness
фосфорная кислота | Купить качественную фосфорную кислоту
Это наша самая популярная фосфорная кислота (h4PO4) — Фосфорная кислота 85% (общее использование)
Фосфорная кислота 85% (общее использование)
Ищете другие варианты этого продукта?
- Индивидуальная упаковка
- Персонализированная маркировка
- Особые размеры упаковки
- Индивидуальное смешивание
- Оптовые количества
- Доступны различные сорта
- MSDS
Заявления
Описание
Ищете фосфорную кислоту для общего применения?
- Мы поставляем фосфорную кислоту общего назначения в 2.Контейнеры 5 л и 25 л, а также бочки 200 л
- Скидки доступны для оптовых заказов от 4 наименований
- Полный MSDS также доступен для загрузки с нашего веб-сайта
Химические и физические свойства фосфорной кислоты
- Имя: Фосфорная кислота
- Альтернативные названия: Ортофосфорная кислота
- Молекулярная формула: H 3 PO 4
- Молекулярный вес: 97.996 г / моль
- Внешний вид: Гигроскопичные бесцветные кристаллы, образующие вязкий раствор в воде
- Запах и вкус: Без запаха, но с кисловатым привкусом
- Точка кипения: 407 ° C (415 ° F)
- Точка плавления: 42,4 ° C (108 ° F)
- Растворимость: Растворим в воде, спирте и эфире
- Разложение: Преобразуется в пирофосфорную кислоту (H 4 P 2 O 7 ) при нагревании до более чем 200 ° C
- Коррозионная активность: Коррозия черных металлов и сплавов
- Кислотность: pH около 1.5 в водном растворе (0,1 н.)
Обычное применение фосфорной кислоты
- Производство удобрений (более 70%)
- Производство сельскохозяйственных кормов
- Обработка воды
- Используется в мыле и моющих средствах
- Используется в пищевая промышленность, включая корм для домашних животных и напитки
- Используется в косметических продуктах и средствах личной гигиены, в частности зубных пастах
- Производство средств пожаротушения
- Антифриз
- Используется в текстильной промышленности
- Используется в качестве катализатора
- Используется в буровая промышленность
- Удаление ржавчины
Насколько безопасна фосфорная кислота?
Как кислота, фосфорная кислота может быть опасной, если с ней не обращаться безопасно.
- Не горюч, но при пожаре выделяет токсичные пары.
- При контакте с кожей может вызвать химические ожоги и волдыри. Это также раздражает глаза.
- При вдыхании или проглатывании вызывает ощущение жжения в горле и затрудненное дыхание. Это также может привести к боли в животе и коллапсу.
Вежливое обслуживание
В ReAgent мы очень гордимся своим дружелюбным обслуживанием. Если вам нужна помощь, член нашей службы поддержки клиентов будет рад помочь вам до, во время и после вашего заказа, чтобы наши продукты соответствовали вашим потребностям.Просто свяжитесь с нами для получения дополнительной информации.
Файлы MSDS
Следующие файлы доступны для загрузки:
Наш самый популярный продукт представлен выше. Другие варианты этого продукта показаны ниже.
Где я могу купить фосфорную кислоту в Великобритании?
Вы можете купить фосфорную кислоту у проверенных британских производителей химической продукции ReAgent. Делайте покупки в Интернете сегодня, где мы продаем фосфорную кислоту в упаковках различных размеров, от контейнеров 2,5 л до бочек 200 л и контейнеров IBC на 1000 л.
Благодаря скидкам на оптовые заказы, обещанию 24-часовой доставки и 100% гарантии качества на все продукты покупка фосфорной кислоты никогда не была такой простой. Посетите наш интернет-магазин сегодня или свяжитесь с нами, чтобы поговорить с членом нашей команды экспертов.
Что такое фосфорная кислота?
Фосфорная кислота, также известная как ортофосфорная кислота, представляет собой бесцветную и вязкую жидкую минеральную кислоту. Он также полностью без запаха. В чистом виде фосфорная кислота представляет собой твердое кристаллическое вещество, хотя редко встречается в таком виде.Высококонцентрированная фосфорная кислота классифицируется как коррозионное вещество. Однако он легко разбавляется и считается нетоксичным при смешивании с водой.
Альтернативный термин, ортофосфорная кислота, иногда используется, чтобы отличить ее от родственных фосфорных кислот, известных как полифосфорные кислоты.
Для чего используется фосфорная кислота?
Фосфорная кислота имеет множество применений как в лаборатории, так и в реальных ситуациях.

